Vedyn isotoopit
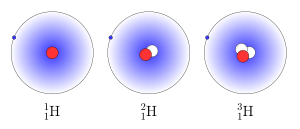
Vedystä tunnetaan seitsemän eri isotooppia. Niistä yleisin, eli vety-1 (protium) sekä vety-2 (deuterium) ovat vakaita, kun taas vety-3 (tritium) sekä synteettisesti tuotetut vety-4, vety-5, vety-6, ja vety-7 ovat radioaktiivisia.
Isotoopit
[muokkaa | muokkaa wikitekstiä]Luonnossa esiintyvät isotoopit
[muokkaa | muokkaa wikitekstiä]Protium
[muokkaa | muokkaa wikitekstiä]Protium (1H) on yleisin luonnossa esiintyvä vedyn isotooppi. Sen suhteellinen osuus muusta vedystä on noin 99.985 prosenttia.[1] Protiumissa ei ole neutroneja.[2]
Deuterium
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Deuterium
Deuteriumilla (2H) on ytimessä yksi neutroni. Sen suhteellinen osuus muusta vedystä on noin 0.015 prosenttia.[3] Deuteriumin löysi vuonna 1931 Harold C. Urey, joka sai tästä vuonna 1934 Nobelin kemianpalkinnon. Deuterium toimii tavallisen vedyn tavoin kemiallisissa reaktioissa, mutta reagoi hitaammin.[4]
Tritium
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Tritium
Tritiumilla (3H) on ytimessään kaksi neutronia. Toisin kuin protium ja deuterium, tritium on epävakaa, eli radioaktiivinen isotooppi, jonka puoliintumisaika on noin 12.32 vuotta. Sen suhteellinen osuus muusta vedystä on häviävän pieni.[5] Tritiumia muodostuu ilmakehän ylemmissä osissa, jossa kosminen säteily osuu ilman typpeen. Luonnossa tritiumia esiintyy lähinnä vedessä. Keinotekoista tritiumia käytettiin 1950–60-luvuilla ydinkokeissa.[6]
Synteettiset isotoopit
[muokkaa | muokkaa wikitekstiä]Vety-4 (4H), vety-5 (5H), vety-6 (6H) ja vety-7(7H) ovat laboratoriossa tuotettuja radioaktiivisia vedyn isotooppeja, joiden puoliintumisajat ovan häviävän pieniä, alle tseptosekunnin. Esimerkiksi vety-4:n puoliintumisaika on vain 9.93696 • 10-23 sekuntia.[7]
Taulukko
[muokkaa | muokkaa wikitekstiä]| Merkki | Z(p) | N(n) | Massa (u) | Puoliintumisaika | Hajoamistapa | Spin | Suhteellinen osuus luonnon vedystä (%) | Lähteet |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1.007825 | ½+ | 99.985 | [1] | ||
| 2H | 1 | 1 | 2.01355321270 | 1+ | 0.015 | [3] | ||
| 3H | 1 | 2 | 3.0160492 | 12.32 vuotta | β− | ½+ | äärimmäisen pieni | [5] |
| 4H | 1 | 3 | 4.0279121 | 9.93696 • 10-23 s | n | 2- | [7] | |
| 5H | 1 | 4 | 5.03531(11) | 8.01930 • 10-23 s | 3n | (1/2) | [8][9] | |
| 6H | 1 | 5 | 6.04494(28) | 2.90(70) • 10-22 s | 3n | 2- | [9] | |
| 7H | 1 | 6 | 7.05275(108) | 2.3(6) • 10-23 s | 2n | 2+ | [9] |
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b Hydrogen atom chemeurope.com. Chem Europe. Viitattu 29.12.2023. (englanniksi)
- ↑ What Is Protium? byjus.com. Byju's. Viitattu 29.12.2023. (englanniksi)
- ↑ a b Deuterium chemeurope.com. Chem Europe. Viitattu 29.12.2023. (englanniksi)
- ↑ Deuterium britannica.com. 28.11.2023. Britannica. Viitattu 29.12.2023. (englanniksi)
- ↑ a b Tritium chemeurope.com. Chem Europe. Viitattu 29.12.2023. (englanniksi)
- ↑ Radionuclide Basics: Tritium 22.7.2023. EPA. Viitattu 29.12.2023. (englanniksi)
- ↑ a b Hydrogen-4 chemeurope.com. Chem Europe. Viitattu 29.12.2023. (englanniksi)
- ↑ Hydrogen-5 chemeurope.com. Chem Europe. Viitattu 29.12.2023. (englanniksi)
- ↑ a b c Isotopes of Hydrogen chemeurope.com. Viitattu 29.12.2023. (englanniksi)
